REPASO: Modelo de Rutherford, número atómico,
número másico e isótopos. Sistema
periódico completo (excepto tierras raras). Las propiedades de los elementos
(Electronegatividad) y el sistema periódico. Enlaces en función de las
diferencias de electronegatividad. Enlace
iónico. Propiedades de los compuestos iónicos. Enlace covalente. Propiedades de
los compuestos covalentes. Enlace metálico. Propiedades de los metales.
Conceptos previos (repaso):
- Modelo de Rutherford
- Número atómico y másico
- Isótopos
Conceptos clave:
- Tabla periódica
- Electronegatividad
- Enlace químico
- Enlace iónico
- Enlace covalente
- Enlace metálico
Objetivos del tema:
- Ser capaz de dar la composición de un isótopo cargado en términos de protones, neutrones y electrones
- Reconocer la información que los grupos y periodos de la tabla periódica proporcionan
- Aplicar la regla del octeto para predecir iones
- Reconocer el tipo de enlace que presenta un compuesto químico
- Asociar propiedades con el tipo de enlace que presenta la sustancia
Documento común: https://titanpad.com/fbPN7jiYiA
REPASO: Modelo de Rutherford, número atómico, número másico e isótopos.
El experimento de Rutherford:
El modelo de Rutherford:

El átomo de Rutherford consiste de un núcleo muy pequeño que contiene la carga positiva y prácticamente toda la masa del átomo, (protones y neutrones), rodeado de electrones que orbitan alrededor de él (corteza). Por eso, la mayor parte de las partículas alfa (cargadas positivamente) atravesaban la lámina de oro sin más, dado que los núcleos son muy pequeños. Sólo aquellas que pasaban muy cerca del núcleo o que iban directas a él sufrían algún tipo de cambio de trayectoria (deflexión o retrodispersión).
El número atómico es el número total de protones que tiene el átomo. Se representa con la letra Z e identifica al átomo. Los átomos de diferentes elementos tienen diferentes números de electrones y protones
El número atómico es el número total de protones que tiene el átomo. Se representa con la letra Z e identifica al átomo. Los átomos de diferentes elementos tienen diferentes números de electrones y protones
El número másico es la suma del número de protones y el número de neutrones. Se simboliza con la letra A.
Se denominan isótopos a los átomos de un mismo elemento, cuyos núcleos tienen una cantidad diferente de neutrones, y por lo tanto, difieren en masa atómica.
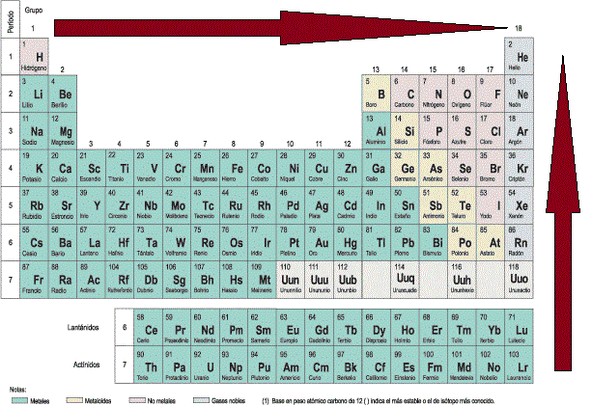
La tabla periódica
Los
elementos en la tabla periódica se ordenan por valores crecientes del
número atómico (Z), pero haciendo que verticalmente coincidan elementos
con propiedades similares.
Las propiedades de los
elementos están relacionadas con el número de electrones que poseen, y
con su ordenación interna. Los electrones se agrupan en capas con un
número diferente de electrones en cada una de ellas.
La tabla periódica está organizada en grupos y periodos.
- Los grupos son verticales, van del 1 al 18, y agrupan a elementos que tienen propiedades similares, debido a que sus capas exteriores son similares. Por ejemplo, el grupo 1 tiene 1 electrón en su última capa, el grupo 18, tiene 8 electrones en su última capa. Algunos grupos tienen nombres especiales: grupo 1, alcalinos; grupo 2, alcalinotérreos; grupo 13, térreos; grupo 17, halógenos; grupo 18, gases nobles.
- Los periodos son horizontales, van del 1 al 7, y los elementos de un periodo tienen el mismo número de capas de electrones, y este número de capas coincide con el del periodo. O sea, que la capa más externa del sodio, por ejemplo, es la 3, mientras que la del calcio, es la 4.
Combinando la información que nos dan grupo y periodo,
podemos obtener información sobre las capas externas de los elementos.
Así, por ejemplo, el K, del grupo 1, periodo 4, tiene 1 electrón en la
capa más externa, que es la 4. O por ejemplo, el Ne, grupo 18, periodo
2, tiene 8 electrones en la capa más externa que es la 2.
Electronegatividad
La electronegatividad es una medida de la fuerza con la que un átomo atrae un par de electrones de un enlace.
Enlace químico
EdTed: How atoms bond
Un enlace químico es la unión de dos átomos de modo que el resultado es más estable energéticamente que los átomos por separado. Hay tres tipos de enlaces químicos:
- Enlace iónico: entre elementos de muy diferente electronegatividad (metal + no-metal). En esos casos, el no-metal le "roba" electrones al metal, formándose iones, y lo que da forma a la sustancia es la interacción electrostática entre dichos iones.
- Enlace covalente: se da entre elementos de alta electronegatividad (no-metal + no-metal). En este caso, los elementos comparten electrones con el objetivo de rodearse cada un de ellos por ocho electrones (octete electrónico), salvo el hidrógeno que se rodea de solo dos.

- Enlace metálico: entre metales, es decir elementos poco electronegativos. En estos enlaces, los electrones de la última capa so compartidos por todos los átomos, teniendo libertad de movimiento entre ellos, y otorgándoles así sus propiedades características.
Tipos de átomos
|
Ejemplos
|
Punto de fusión
|
Solubilidad
|
Conductividad eléctrica
|
Conductividad térmica
|
Otras propiedades relevantes
| |
Sustancias iónicas
|
Metales y no metales
|
NaCl
|
Altos
|
Solubles en agua
|
No conducen en estado sólido, pero sí sus disoluciones
|
No conducen bien el calor
|
Frágiles
|
Sustancias covalentes moleculares
|
No metales.
|
Metano
|
Bajos puntos de fusión y ebullición.
|
Generalmente insolubles en
agua, y solubles en disolventes orgánicos, pero depende de la polaridad.
|
No conducen la electricidad.
|
No conducen el calor.
|
Existen compuestos gaseosos, líquidos y sólidos, pero los sólidos son frágiles y quebradizos, o blandos y de aspecto céreo.
|
Sustancias covalentes no moleculares
|
No metales.
|
Cuarzo, diamante, granito...
|
Muy altos.
|
Insolubles
|
No conducen la electricidad.
|
No conducen el calor.
|
Son muy duros.
No existen moléculas individuales.
|
Sustancias metálicas
|
Metales
|
Bronce, cobre
|
Muy variados.
|
Insolubles
|
Muy buenos conductores eléctricos.
|
Muy buenos conductores del calor.
|
Son dúctiles y maleables.
|
No hay comentarios:
Publicar un comentario